Drug Design
Drug Design - Arzneimittel am "Reißbrett" konstruieren
Molecular Design – Drug Design – Drug Modelling – es bedeutet immer das Gleiche: der Versuch, neue Arzneimittel mit Hilfe des Computers zu finden („designen“). Wer solche Versuche am Computer selbst erlebt hat ist fasziniert – selbst bei Fachkollegen taucht immer wieder die Frage auf: warum machen wir das nicht grundsätzlich so?
Die Voraussetzung dafür, Molecular Design erfolgreich einzusetzen ist die Kenntnis der exakten räumlichen Struktur sowohl des Wirkstoffes, als auch der Umgebung von Rezeptoren, also jenen biologischen Sensoren im Organismus, an welche ein Arzneimittel seine Information weiterleitet, um an einem beabsichtigten Wirkort eine bestimmte Wirkung zu entfalten. Die Struktur des Wirkstoffes (Arzneimittel) ist im allgemeinen bekannt, denn der Chemiker hat die Struktur eines neues Wirkstoffes ja selbst geplant oder als Naturstoff (z.B. aus einer Pflanze) isoliert und analysiert. Zur Patentierung einer neuen Wirksubstanz ist die Strukturformel unbedingt erforderlich (nur in Einzelfällen auch deren räumliche Struktur).
Die wichtigsten Methoden eine chemische Struktur während der Synthese und deren Endprodukt zu kontrollieren oder eine unbekannte Struktur zu ermitteln, sind heute die Kernmagnetische Resonanz Spektroskopie (NMR, auch Kernspinresonanz genannt) (1) und die Massenspekroskopie (MS) (2). Beide Methoden sind heute so verfeinert, dass man selbst kompliziertere Moleküle in relativ kurzer Zeit analysieren kann.
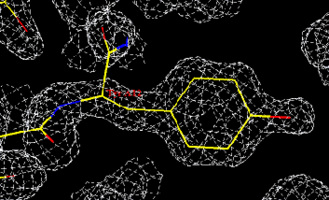
Bei einfachen Molekülen lässt sich aus einer chemischen Strukturformel durch entsprechende Rechenprogramme unter Berücksichtigung der Atomgrößen und Abstände eine ungefähre räumliche Struktur darstellen. Wirklich genaue Vorstellungen der räumlichen Struktur lassen sich jedoch nur mit Hilfe der Röntgenstrukturanalyse ermitteln. Bei dieser Methode trifft ein Röntgenstrahl auf einen sich langsam drehenden Kristall der zu analysierenden Substanz und dabei werden Reflexe (das Beugungsgitter) der Atom- bzw. Kristallgitterebenen aufgezeichnet. Da der Röntgenstrahl nicht nur an der Oberfläche reflektiert wird, sondern auch in den Kristall eindringt, entsteht eine Vielzahl von Reflexen, aus denen die exakte räumliche Struktur der chemischen Verbindung berechnet werden kann (3).
Anm.: Streng genommen sieht man nicht die Positionen der einzelnen Atome, sondern es wird die Verteilung der Elektronen in der Elementarzelle in Form einer Elektronendichtekarte bestimmt.
Während sich synthetisierte Wirkstoffe im allgemeinen leicht kristallisieren lassen (Voraussetzung für die Röntgenstrukturanalyse), ist dies bei den wesentlich komplizierteren Eiweißstrukturen der Rezeptore oder deren Umgebung nur begrenzt möglich - genau dies ist der Grund, warum "Drugsesign" nur in Einzelfällen so erfolgreich anwendbar ist. Bei dieser Methode wird nämlich versucht, die Struktur des Wirkstoffes am Bildschirm so in die Proteinumgebung des Rezeptors einzupassen, dass er möglichst nahe an den Rezeptor herankommt – je näher, desto stärker ist die Wirkung des Arzneimittelwirkstoffes. Die Chemiker können anhand solcher Computersimulationen ihre Moleküle so variieren (durch Abänderung von Strukturteilen), dass der Wirkstoff optimal in die räumliche Umgebung der Eiweißumgebung passt. Eiweiße (Proteine) sind leider meist sehr komplizierte, aus vielen Aminosäuren zusammengesetzte Stoffe, die wegen ihrer Größe und räumlichen Vielfalt nur selten kristallisierbar sind. In diesem Fall kann man zwar versuchen, durch vereinfachte simulierte Strukturmodelle verwendbare Vorstellungen zu gewinnen, die meisten dieser Versuche führen jedoch nicht immer zum gewünschten Ziel. Aus diesem Grunde ist es derzeit noch nicht möglich, neue Wirkstoffe grundsätzlich am „Reißbrett“zu konstruieren, sondern die Methode dient in erster Linie dazu, bei Kenntnis der räumlichen Strukturen, die pharmakologische Wirkung zu optimieren und ungefähre Vorstellungen über Proteine (Eiweiße) zu haben.
(1) NMR: Dieses Messverfahren beruht auf einer elektromagnetischen Anregung von Atomkernen (nur bei Atomen mit ungerader Ordnungszahl= Zahl der Protonen im Atomkern, z.B. Wasserstoff (H1), Fluor (F19) oder radioaktiven Isotopen von Kohlenstoff (C13) oder Phosphor (P31) und der anschließenden Messung des Signals, das die Kerne erzeugen, während sie wieder in ihren nichtangeregten Grundzustand übergehen). Diese Methode wird heute auch in der medizinischen Diagnostik in der Kernspintomografie zur Erkennung von Gewebestrukturen im Körperinnern verwendet (MRT, Magnetresonanz Tomografie= MRI, Magnetic Resonance Imaging).
(2) In der Massenspektrometrie (MS)wird das chemische Molekül im Vakuum an einer Ionenquelle „zertrümmert“ und die einzelnen Bruchstücke entsprechend ihrer unterschiedlichen Massen in einem Magnet- oder elektrischen Feld so getrennt, dass sowohl die Art der Bruchstücke (Atome oder Atomgruppen) als auch die Anzahl im Verhältnis zur Gesamtmasse in einem „Spektrum“ aneinandergereiht bestimmt werden können. Aus den einzelnen Bruchstücken lässt sich die Gesamtstruktur berechnen (die Massenspektrometrie entspricht etwa der Methode eines Archäologen, aus gefundenen Tonscherben durch Zusammensetzung der Scherben das ursprüngliche Tongefäß zu rekonstruieren).
NMR und MS führen zunächst nicht zu der räumlichen Darstellung der chemischen Struktur, sondern nur zur „chemischen Strukturformel“, es ist aber z.B. mit NMR möglich, Rückschlüsse auf räumliche Anordnungen zu ziehen.
(3) Bei der Proteinkristallographie (siehe Blogbild) wird die Struktur ermittelt, indem die Aminosäuresequenz in die Elektronenverteilung (weißes Gitter) eingepasst und modifiziert oder verschoben wird, bis plausibel ist, dass die gewählte Struktur die ermittelte Elektronenverteilung erzeugen kann.
(4) Nach Meinung des Verfassers dieses Beitrages ist es auch fraglich, inwieweit „Einkristalle“ von Proteinen für Drug Design wirklich aussagekräftig sind, weil diese komplizierten Moleküle im Organismus in verschiedenen „Fältelungen“ vorliegen können, deren Faltung oft nur durch die bekannten „Spurenelemente“ oder durch bestimmte Enzyme zu einer im Organismus wirksamen Form gebracht werden.
(AR)
(Version 29.11.2012)