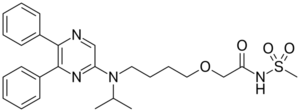
Selexipag (ACT-293987, NS-304), ein neuer Wirkstoff gegen pulmonale arterielle Hypertonie (PAH)
Pulmonale arterielle Hypertonie ist eine chronische, lebensbedrohliche Erkrankung, gegen die es bisher nur wenige, meist intravenös zu verabreichende Prostazyklin-Therapien, gibt.
Die Firma Actelion berichtet jetzt über sehr ermutigende Ergebnisse einer Phase III-Studie (1) (Gryphon-Studie, siehe Anm.) mit „Selexipag“, das erstmals im Unterschied zu den bisher eingesetzten Prostazyklin-Analoga eine für den Rezeptor spezifische, oral verfügbare Substanz wäre. Selexipag (und sein aktiver Metabolit ACT-333679) sind Agonisten des PGL2 Prostaglandin Rezeptors, der zur Vasodilation des pulmonalen Kreislaufs führt.
Dr. Gérald Simonneau, Professor für Pneumologie und Leiter der Abteilung für Lungenerkrankungen und Intensivmedizin am Spital Le Kremlin-Bicêtre der Universität Paris-Süd in Frankreich, Mitglied des Lenkungsausschusses, kommentiert die Substanz: "Seit fast zwanzig Jahren verschreibe ich PAH-Patienten intravenöse Prostazyklin-Therapien. Die heute vorliegenden Ergebnisse von GRIPHON bringen uns einen wesentlichen Schritt weiter. Zum ersten Mal verfügen wir mit Selexipag über eine oral zu verabreichende Substanz, die über den Prostazyklin-Signalweg wirkt, und für die eine signifikante Verringerung des Risikos im Hinblick auf einen klinisch hoch relevanten Endpunkt belegt ist."
Anm.: Die GRIPHON-Studie ist eine multizentrische, doppelblinde, plazebokontrollierte Morbiditäts- und Mortalitätsstudie der Phase III, bei der die Wirksamkeit und Sicherheit von oralem Selexipag bei Patienten mit pulmonaler arterieller Hypertonie (PAH) untersucht wird. Der primäre Endpunkt der Studie besteht im Nachweis der Wirksamkeit von Selexipag bis zum Zeitpunkt des ersten klinischen Ereignisses (Morbidität oder Mortalität) bei PAH-Patienten. Die Studie wird im Rahmen eines mit der amerikanischen Food and Drug Administration vereinbarten Special Protocol Assessment (SPA) durchgeführt (2).
Die Substanz ist noch nicht zugelassen und daher nicht im Handel, es wird jedoch damit gerechnet, dass eine Zulassung aufgrund des bisher ermutigenden Ergebnisse bald erfolgen wird.
(AR)
(20.6.2014)
Quellen:
(1) http://www.wallstreet-online.de/nachricht/6818490-selexipag-erreicht-primaeren-endpunkt-zulassungsrelevanten-phase-iii-studie-griphon-patienten-pulmonaler-arterieller-hypertonie
(2) http://www1.actelion.com/en/journalists/medieninformationen.page?newsId=1416341