PHARMA SELECTED - Magazin für innovative medizinische und pharmazeutische Forschung. Ausgewählte Beiträge zur Stammzellen- und gentechnologischen Forschung, sowie zu neuen Arzneimittelstoffen.
Das Magazin PHARMA SELECTED versucht, interessante originelle Ideen aufzupüren, bei denen zumindest ansatzweise die Hoffnung besteht, entweder den Erkenntnisstand eindeutig zu erhöhen oder im günstigsten Fall, zu einem wertvollen therapeutisch einsatzfähigen Produkt zu führen.
▼ NEUE BEITRÄGE
(allgemeines)
Der letzte allgemeine Beitrag zum Thema Pharmaforschung dieses Journals wurde 2012 verfasst (1). Seither ist sehr viel Zeit vergangen und doch gelten die meisten damals beschriebenen Fakten für diese innovative Forschung auch heute noch.
Was hat sich verändert?
• Die Molekularbiologie hat gewaltige Fortschritte gemacht, es gibt heute für viele Krebsarten bereits hochwirksame Wirkstoffe (meist monoklonale Antikörper), die auch ohne die gefürchtete „Chemotherapie“ sogar metastasierende Karzinome zurückdrängen oder sogar heilen können.
• Die Immuntherapie
Das Ziel der Immuntherapie ist, Ausweichstrategien der Krebszellen gezielt zu umgehen und das körpereigene Immunsystem gegen den Krebs zu lenken.
Derzeit gibt es verschiedene Formen der Immuntherapie: Die Behandlung mit monoklonalen Antikörpern (siehe oben), Impfungen mit Tumorantigenen, die Immuntherapie mit "Checkpoint-Inhibitoren" und die CAR-T-Zell-Therapie.
Unser Immunsystem hat die Aufgabe, unseren Körper vor Viren, Bakterien und anderen Krankheitserregern zu schützen. Lymphozyten und andere weiße Blutkörperchen wandern über den Blutkreislauf ständig durch unseren Körper. Sie spüren Krankheitserreger wie Viren, Bakterien oder geschädigte Zellen auf, insbesondere die T-Zellen beseitigen sie dann.
Die zweite Ebene des Abwehrsystems bilden Antikörper (Eiweißkörper), die von B-Lymphozyten und Plasmazellen produziert werden. Diese Antikörper können Krankheitserreger oder körperfremde Zellen anhand von bestimmten Strukturen auf ihrer Zelloberfläche (Antigene) erkennen, binden und damit unschädlich machen. Heute ist es möglich, Antikörper gegen verschiedene Zielstrukturen im großtechnischen Ausmaß in Labors künstlich herzustellen und für die Behandlung einzusetzen. Ein typisches Beispiel dafür sind Impfungen gegen Grippeviren, die zur Bildung von Antikörpern gegen die Grippeerreger führen und diese bei Kontakt unschädlich machen.
Bei der CAR-T-Zell Therapie werden zunächst T-Zellen aus dem Blut des Patienten gewonnen, die dann im Labor gentechnisch so verändert werden, dass sie chimäre Antigenrezeptoren (CAR) auf ihrer Oberfläche bilden, die gegen krebsspezifische Oberflächenproteine gerichtet sind. Die Immunzellen werden somit künstlich auf den Krebs abgerichtet. „Die so veränderten CAR-T-Zellen werden dem Patienten zurückinfundiert, wo sie sich idealerweise vermehren und zu einer heftigen und langanhaltenden Immunreaktion gegen den Krebs führen“. (Zitat aus der Wikipedia Enzyklopedie).
Wie die meisten Krebstherapien kann auch die CAR-T-Zell-Therapie schwere Nebenwirkungen verursachen. Eine der häufigsten Nebenwirkungen ist das sogenannte cytokine-release syndrome (CRS) mit teils lebensbedrohlichen Nebenwirkungen wie Fieber, Schüttelfrost, Atembeschwerden und Hautausschlägen. Diese Beschwerden werden vermutlich durch den massiven Zerfall der Krebszellen verursacht, wodurch eine Vielzahl von Zytokinen freigesetzt wird. Im August 2017 wurde seitens der US-amerikanischen Zulassungsbehörde (FDA) Tocilizumab (Handelsname: Actemra/RoActemra ,Hersteller: Roche) zur Behandlung des CRS zugelassen.
Die Preise von Immunpharmaka sind meist sehr hoch und werden auch in der näheren Zukunft nicht sinken. Die Forschungskosten sind wegen der langen Zulassungszeiten (und der dafür benötigten Analytik) unglaublich hoch und werden nur in Einzelfällen von den Krankenkassen übernommen. Die Herstellerfirmen rechnen damit, dass die Kassen in Zukunft solche Kosten übernehmen werden, weil sogar mehrfache ambulante Gaben der neuen Immuntherapeutika erheblich billiger sind als lange stationäre Klinikaufenthalte, die sich bei der klassischen Chemotherapie nicht vermeiden lassen.
• Die klassische Arzneimitteltherapie und Generica (2)
Die klassische Arzneimittelchemie hatte ihre fruchtbarste Periode zwischen 1960 und 1985, nach dem „Conterganskandal“ – Wirkstoff Thalidomid (siehe Anm.). Die in dieser Zeit entwickelten Arzneimittel wurden durch inzwischen neu entwickelte toxikologische Prüfverfahren in internen und externen klinischen Studien geprüft, andernfalls hätten sie keine FDA-Zulassung erhalten. Die Originalpräparate sind auch heute noch im Handel, vielfach werden diese jedoch durch preiswertere Generika ersetzt (2).
Anm.: der Ausdruck „Skandal“ ist bei Thalidomid nur gerechtfertigt, weil das „Sedativum“ erst zwei Jahre nach Bekanntwerden der toxischen Wirkungen aus dem Handel genommen wurde, da es 1956 nur wenige und unzuverlässige toxikologische Prüfverfahren gab. Trotzdem ist das Präparat noch immer als Lepra-Mittel im Handel – seit 1999 allerdings unter hohen Auflagen. Besonders tragisch ist, dass nur das rechtsdrehende (+)Enantiomere die teratogenen Schädigungen aufweist (Thalidomid ist eine chirales Stereomeres - die Trennung von Enantiomeren ist sehr kostspielig). Auch heute werden viele Arzneimittel als Enantiomere verkauft, nur müssen die klinischen Untersuchungen dann mit beiden Enantiomeren gesondert geprüft werden.
Ein Großteil der heute verschriebenen und in den Apotheken verkauften Arzneimittel sind aus Kostengründen Generika, die nach anfänglichen Schwierigkeiten hinsichtlich der Bioverfügbarkeit heute jedoch wirkungsgleich den teureren Originalpräparaten entsprechen. Trotzdem muss bedacht werden, dass Generika allenfalls dem Wissenstand vom Ende der 90-iger Jahre entsprechen.
Warum wird heute kaum noch an Arzneimitteln im „klassischen“ Sinn geforscht?
- Die Forschung an synthetischen chemischen Arzneistoffen ist heute schwieriger, weil es zunehmend neue Erkenntnisse bezüglich der molekularbiologischen Ansatzpunkte gibt.
- Toxikologische firmeninterne Vorprüfungen sind komplizierter, weil auch hier neue Testverfahren die Erfahrungen für erste Versuche an Menschen verlängern und dadurch der Weg zu ersten klinischen Studien deutlich teurer geworden ist.
- Die darauffolgenden klinischen Studien sind der kostspieligste Teil zur Entwicklung neuer Pharmaka und fast so kostenintensiv, wie die Entwicklung immunologischer Therapeutika. Trotzdem gehört die Zukunft der Immuntherapie.
Anm.: Immuntherapeutika sind zwar wesentlich teurer als herkömmliche Arzneimittel und die hohen Verkaufspreise werden kaum sinken, weil der analytische und klinische Aufwand bis zur FDA-Zulassung nicht sinken wird. Die meisten solcher Therapeutika werden derzeit noch nicht, oder nur unter bestimmten Voraussetzungen von den Krankenkassen bezahlt. Die großen Pharmahersteller rechnen jedoch damit, dass diese Kosten in absehbarer Zeit trotzdem von den Kassen übernommen werden, weil die oft ambulanten und selteneren Behandlungen insgesamt billiger sind, als laufende stationäre Klinikaufenthalte unter Anwendung der klassischen Chemotherapie.
Demenzerkrankungen
Nachdem Demenzerkrankungen infolge der gewachsenen Lebenserwartung eine neue Herausforderung für die Forschung bedeuten, beschäftigen sich insbesondere die großen Pharmahersteller intensiv mit diesem Thema. Allerdings ist Demenz nicht gleich Demenz, sondern ein Oberbegriff verschiedener Formen der Beeinträchtigung kognitiver, emotionaler und sozialer Fähigkeiten.
Anm.: Die Neuauflage des US-amerikanischen Diagnostic and Statistical Manual of Mental Disorders (DSM-5) verwendet den Begriff der Demenz nicht mehr, sondern spricht von neurokognitiven Störungen (neurocognitive disorders, NCD) und schließt alle erworbenen Hirnleistungsstörungen ein, mit Ausnahme kognitiver Beeinträchtigungen bei Psychosen oder Schizophrenie und kognitive Störungen bei Hirnentwicklungsstörungen.
Heute sind die Ursachen einiger Demenzen geklärt, bei vielen Formen gibt es jedoch noch keine eindeutigen und deshalb unumstrittenen Erkenntnisse zur Entstehung. Einige wenige Formen von Demenz sind reversibel, bei einigen anderen Formen sind in begrenztem Umfang therapeutische Interventionen möglich, die allerdings oft nur eine Verzögerung des Auftretens bestimmter Symptome bewirken können.
Die häufigste Form einer Demenz ist die Alzheimer-Krankheit, deren Ursache im Stoffwechsel zwar bekannt ist, nicht aber die Ursache der Entstehung. Trotz intensiver weltweiter Forschung, gibt es noch kein Heilmittel, obwohl die zahllosen Publikationen und theoretischen Therapieansätze oft falsche Hoffnungen machen.
Die normale Altersvergesslichkeit hat mit der Alzheimer-Krankheit nichts zu tun. Der Abbau von Gedächtnisleistungen ähnelt meist dem natürlichen Abbau aller anderen Körperzellen. In vielen Fällen kann die Gabe von Neurotransmitter stimulierenden Substanzen hilfreich sein. Solche Substanzen wirken oft auch recht gut bei der Parkinson-Krankheit.
Schizophrenie ist heute durch Antipsychotika gut behandelbar. Die nach dem Clozapin (1972) eingeführten Antipsychotika haben nicht mehr die starken Nebenwirkungen wie Clozapin, das u.a. Blutbildveränderungen verursachte.
Die Frage, inwieweit Demenzerkrankungen durch Vererbung entstehen, ist noch nicht geklärt. Hier gilt wohl die Erkenntnis, dass viele Krankheiten zwar letztlich vererbt werden, dass es später jedoch oft darauf ankommt, wie mit solchen Vererbungen umgegangen wird.
FACIT: Schließlich wird auch an gentechnologischen Methoden zur Behandlung von Krankheiten weltweit und intensiv gearbeitet. Es wird allerdings wohl noch lange dauern, bis einsatzbare Methoden vorliegen - dementsprechend sollten die Hoffnungen darauf derzeit nicht zu hoch sein.
(AR, 21.10.2019)
- Betrachtungen zur Vergabe von Nobelpreisen im modernen Wissenschaftsbetrieb https://www.pharma-select.net/allgemeines/betrachtungen-zur-vergabe-von-nobelpreisen-im-modernen-wissenschaftsbetrieb/
- Generica und Biosimilars https://www.pharma-select.net/allgemeines/generica-anf%C3%A4nge-ist-zustand-und-zukunft/
(andere Erkrankungen)
Vor Kurzem wurde eine Warnung von der FDA beim Gebrauch dieses Mittels ausgesprochen - siehe dieses Magazin(1). Jetzt hat Novartis eine erweiterte Zulassung erhalten: künftig dürften auch Kinder und jugendliche Patienten, die an Multipler Sklerose leiden, mit dem Mittel behandelt werden.
Die Entscheidung der Europäischen Kommission basiere auf den Ergebnissen aus der PARADIGMS-Studie, berichtete der Konzern am Donnerstagmorgen 29.11.2018. I der Studien hatte sich gezeigt, dass Gilenya die Rückfallraten um 82 Prozent gegenüber einer Interferon-beta-1a-Behandlung deutlich reduziert habe.
Wie der Konzern weiter erklärte, leiden junge MS-Patienten häufiger an schwerwiegenden Rückfällen als Erwachsene. Gilenya ist die erste und einzige Therapie, die auch für diese jungen Menschen nun in der EU zugelassen ist. Für erwachsene Patienten ist das Mittel schon länger zugelassen.
Zugelassen ist das Mittel bekanntlich seit 2010. Dabei wird es zur Behandlung der schubförmig auftretenden MS, der sogenannten relapsing MS, eingesetzt. Gilenya war im letzten Jahr mit fast 3,2 Mrd. USD das umsatzstärkste Medikament im Portefeuille von Novartis. An einem Investorenanlass Anfang November pries das Unternehmen Gilenya als sichere und im Vergleich mit der Konkurrenz effektivere Behandlung der multiplen Sklerose an. Man verwies auf insgesamt positive Daten bei mehr als 260’000 behandelten Patienten weltweit (2).
Zum Wirkmechanismus von Gilenya (Fingolimod) besuchen Sie bitte die unter (3) angegebene Seiite dieses Magazins
(AR 30.11.2018)
Siehe auch:
(2) https://www.fuw.ch/article/novartis-erhaelt-eu-zulassung-fuer-ms-medikament/
(3) Gilenya®, Fingolimod (Novartis) ein Mittel gegen schubförmige Multiple Sklerose – Warnung durch FDA
Luxturna® - eine Gentherapie gegen eine seltene Form von Makuladegeneration im Jugendalter
(andere Erkrankungen)
Wie Novartis am Freitag, den 23.11.2018 mitteilte, hat die EU-Kommission die Zulassung für seine Gentherapie Luxturna® erteilt. Die Betroffenen erblinden oft in jungen Jahren.
Die Zulassung für die Gentherapie Luxturna® (Voretigen neparvovec) ist laut der Deutschen Presse-Agentur keine Überraschung, nachdem der EU-Ausschuss für Humanarzneimittel (CHMP) Mitte September eine positive Empfehlung für das Mittel abgegeben hatte. Indikation ist eine erbliche Augenerkrankung, die auf eine Mutation im RPE65-Gen zurückzuführen ist und zum vorzeitigen Untergang der Netzhaut führt. Das Gen codiert nämlich ein Enzym namens Retinoid-Isomerohydrolase, welches in den Pigmentepithelien der Retina wird und für das Recycling des Sehpigments benötigt wird. Bei von dieser vererbten Mutation der Betroffenen, bei denen beide Allele mutiert sind, kommt es zu einem schrittweisen Verlust des Sehvermögens, das sich bereits im frühen Kindesalter bemerkbar macht. Eines der ersten Symptome ist ausgeprägte Nachtblindheit(1).
Bei Licht ist die Sehschärfe beeinträchtigt, über die Jahre wird das Sehfeld immer kleiner. Viele Betroffene erblinden im Alter von etwa 20 Jahren vollständig. Die Erkrankung wird autosomal-rezessiv vererbt und ist relativ selten. In Deutschland sind schätzungsweise 200 Menschen betroffen. Mutationen im RPE65-Gen gehören zu einer Reihe von schätzungsweise 220 Gendefekten, die zu einem vorzeitigen Absterben von Retinazellen führen.
Im Gegensatz zu CAR-T-Zellen (CAR=chimeric antigen receptor) bei der patieneigene Zellen ex vivo therapeutisch behandelt und zurückgeführt werden, wird Luxturna® direkt appliziert, nämlich unter die Netzhaut. Es handelt sich dabei um adenoassoziierte Viren, die Pigmentzellen der Netzhaut „infizieren“ und dort eine korrekte Version des RPE65-Gens einbringen. Die Zelle ist dann in der Lage wieder ein funktionsfähiges RPE65-Protein herzustellen. Der Gendefekt wird sozusagen repariert. Darin besteht ein weiterer Unterschied zur CAR-T-Zell-Therapie, bei der keine spezifische Mutation therapiert wird, sondern die genetische Information für die Bildung von CAR zusätzlich eingebracht wird.
Einmal abgestorbene Retinazellen können mit Luxturna® nicht wiederbelebt werden, weswegen die Therapie möglichst früh begonnen werden soll(2).
Es ist noch nicht bekannt, wie lange die Wirkung anhält, da es noch keine diesbezüglichen Zulassungsstudien gibt. Frühere, kleinere Studien deuten an, dass der Effekt mindestens drei Jahre lang anhält. In den USA, wo das Mittel schon länger zugelassen ist, betragen die Therapiekosten USD 850,000, in Europa wird das Präparat sicherlich etwas billiger, aber wie alle Gentherapien teuer bleiben.
Entwickelt wurde Luxturna vom US-Unternehmen Spark Therapeutics. Novartis hatte die Therapie Ende Januar 2018 über eine Lizenzvereinbarung übernommen. Die Schweizer dürfen Luxturna® in allen Ländern außerhalb der USA vertreiben.
Quellen:
(AR, 24.11.2018)
(andere Erkrankungen)
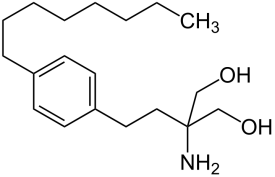
Fingolimod ist eine chemische Verbindung die unter dem Handelsname Gilenya als Arzneisoff zur Behandlung von Multipler Sklerose (MS) seit 2011 in den USA, der EU und in der Schweiz zugelassen ist. Es handelt sich um ein Suppressivum und ist eine synthetische Nachbildung des natürlichen Wirkstoffs Myriocin (1) aus dem Pilz isaria sinclairii.
Fingolimod ist in der EU zur Behandlung von Patienten mit hochaktiver, schubförmig-remittierender MS als Alternativtherapie nach einer Behandlung mit Interferon-Beta oder bei einer rasch fortschreitenden schweren MS zugelassen.
In der Entwicklungsphase III wurde seit 2006 untersucht, ob die in der Phase II beobachteten Wirkungen über längere Zeit stabil bleiben bzw. ob eine Behandlung mit Fingolimod die Entwicklung der mit MS verbundenen Behinderung verlangsamen kann. Diese Studien wiesen eine Wirksamkeit hinsichtlich der Schubrate bei Patienten mit primär-progredienter Multipler Sklerose auf. Bis Ende 2014 wurde jedoch erfolglos die Behandlungsoption für Patienten mit primär-progredienter Multipler Sklerose untersucht.
Zum Wirkungsmechanismus
Fingolimod wirkt als Sphingosin-1- Analogon (2). Im Gegensatz zu vielen bisher verfügbaren immunsuppressiven Medikamenten werden durch Fingolimod die Immunzellen nicht abgetötet oder an ihrer Vermehrung gehindert. Stattdessen hemmt Fingolimod die Wanderung von Lymphozyten aus den lymphoiden Organen ins Blut und damit die Zahl der entzündungsfördernden Lymphozyten, die im Zentralnervensystem schädigend wirken könnten (3).
Novartis testete Fingolimod auch in Kombination mit Cyclosporin zur Unterdrückung der Abstoßungsreaktion nach Nierentransplantationen In der klinischen Prüfung der Phase III zeigten sich jedoch Nebenwirkungen wie z.B. Makula-Ödeme, besonders bei Diabetikern mit Prädisposition zu Retinopathie. Ferner trat eine leichte Funktionseinschränkung der frisch transplantierten Nieren auf, weshalb die Entwicklung von Fingolimid eingestellt wurde.
Jetzt hat die US-Gesundheitsbehörde Novartis gewarnt. Die Behörde sagt, wenn die Behandlung gestoppt werde, könne die Krankheit viel schlimmer werden als vor Beginn oder während der Einnahme des Medikaments. Diese Verschlechterung sei selten, könne aber zu einer dauerhaften Invalidität führen, hieß es weiter (4)
(1). Myriocin (Cayman Chemical) https://www.caymanchem.com/product/63150
(2). Sphingosin ist ein einfach ungesättigter Aminoalkohol, dessen Moleküle aus 18 Kohlenstoffatomen, einer Aminogruppe und zwei Hydroxygruppen bestehen und wird im Körper aus Palmitoyl-CoA und Serin synthetisiert (siehe Wikipedia-Enzyclopädie)
(3). Quelle: Wikipedia- Enzyklopädie
(4). Finanz und Wirtschaft v. 21.11.2018
(AR, 21.11.2018)
Faricimab gegen neovaskuläre altersbedingte Makuladegeneration
(andere Erkrankungen)
Emicizumab, Hemlibra® - ein vielversprechendes neues Mittel gegen Hämophilie A
(Immuntherapeutika)
Promacta® (Etrombopag), Revolade® - bei schwerer aplastischer Anämie (SAA) und bei ITP
(Immuntherapeutica)
Weitere Erfolge von Roche mit Tecentriq und Hemlibra® (Emicizumab)
(Immuntherapeutica, Krebsforschung)
Ramucirumab, Cyramza® – ein neuer Angiogenesehemmer
(Krebsforschung)
Infektionskrankheiten